

L'equivalente in acqua può essere valutato in maniera qualitativa, come è stato fatto per l'esperimento che con Bruno Martemucci abbiamo proposto a fine gennaio alla quarta classe, oppure realizzando un esperimento a parte. Un semplice esperimento che può essere realizzato è quello descritto su it.wiki (ho modificato la notazione delle formule per adattarla a quella che utilizzerò più avanti):
Per la sua misura si introduce dentro il calorimetro una quantità di acqua nota, $m_1$, che una volta raggiunto l'equilibrio termico con il calorimetro si trova a temperatura $T_1$. Successivamente si aggiunge un'altra quantità di acqua nota, $m_2$, a temperatura $T_2$, e si aspetta il raggiungimento del nuovo equilibrio termico a temperatura $T_{eq}$. Le quantità di calore scambiate devono essere uguali: \[\left ( m_1 c_{H_2 O} + C_c \right ) \left ( T_1 - T_{eq} \right ) = m_2 c_{H_2O} \left ( T_{eq} - T_2 \right )\] dove $C_c = m_{eq} c_{H_2O}$ è la quantità di calore assorbita dal calorimetro. Quindi, sostituendo: \[\left ( m_1 + m_{eq} \right ) \left ( T_1 - T_{eq} \right ) = m_2 \left (T_{eq} - T_2 \right )\] si ricava l'equivalente in acqua del calorimetro: \[m_{eq} = \frac{m_2 \left ( T_{eq} - T_2 \right ) - m_1 \left ( T_1 - T_{eq} \right )}{T_1 - T_{eq}}\]Fatto questo è quindi semplice determinare il calore specifico del metallo riscaldato: basta, infatti, uguagliare la quantità di calore guadagnata dal sistema acqua-calorimetro con quella persa dal metallo: \[\left ( m_{H_2O} + m_{eq} \right ) c_{H_2O} \left (T_{eq} - T_{H_2O} \right ) = m_M c_M \left (T_M - T_{eq} \right )\] dove $m_M$ è la massa del metallo, $c_M$ il suo calore specifico, $T_M$ la temperatura iniziale del metallo.
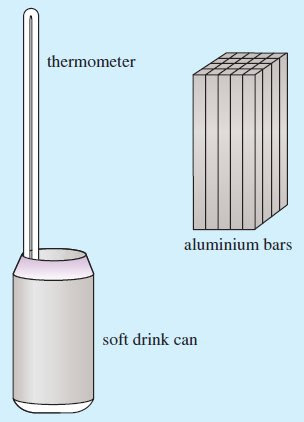
Dalla formula precedente è semplice ricavare il calore specifico del metallo, o anche il calore specifico relativo (in questo modo non bisogna, necessariamente, utilizzare il calore specifico dell'acqua con le unità di misura del Sistema Internazionale): \[\frac{c_M}{c_{H_2O}} = \frac{\left ( m_{H_2O} + m_{eq} \right ) \left ( T_{eq} - T_{H_2O} \right )}{m_M \left (T_M - T_{eq} \right )}\] E' ad ogni modo interessante notare come si può determinare il calore specifico di un metallo anche senza utilizzare un calorimetro, ma semplicemente versando l'acqua all'interno di un recipiente metallico dello stesso tipo del metallo di cui si vuole determinare il calore specifico. Questo sistema risulta molto semplice da portare a termine utilizzando un pezzo di alluminio e immergendolo in una lattina piena di acqua(2).

Approfonidmenti: Calorimetry, Misura dell'equivalente in acqua del calorimetro (pdf)
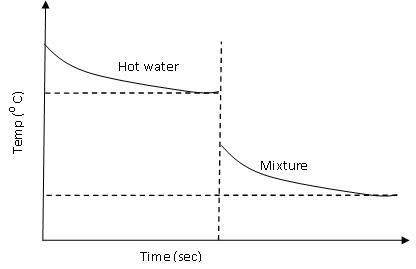
(1) A titolo di esempio, osservare questa figura relativa alla determinazione dell'equivalente in acqua del calorimetro:
(2) Silva, W., Precker, J., Silva, D., & Silva, C. (2004). A low-cost method for measuring the specific heat of aluminium Physics Education, 39 (6), 514-517 DOI: 10.1088/0031-9120/39/6/008

Ecco, quella della raccolta, elaborazione, filtraggio e rappresentazione dei dati è un punto cruciale di qualsiasi esperimento scientifico. Su questo argomento non sempre il docente di turno mette in risalto l'importanza di queste fasi e allora ti ritrovi studenti che durante l'esperimento, carta e penna alla mano, appuntano i vari dati, poi però, quando alla fine c'è da metter giù una relazione, di questi dati non sempre si sa bene che farci o quali strumenti di elaborazione e/o rappresentazione eventualmente utilizzare. Voglio dire che il laboratorio e gli eventuali esperimenti che si svolgono sono quasi sempre mirati al raccoglimento di dati, ecco, agli studenti andrebbe insegnato ad interagire correttamente con questi dati, magari anche introducendo software che possano aiutare nel compito. Oggi come oggi una delle funzioni lavorative più richieste è quella del data mining. In ogni campo siamo sommersi di dati e quindi persone che sanno come "trattarli" risultano sempre molto utili e quindi anche richieste.
RispondiElimina